DiaScreen - PN-III-P2-2.1-PED-2019-3268
Rezultate
Etapa 1
Etapa 1 a proiectului a prevăzut pregătirea documentației necesare realizării activităților de cerctare, colectare, prelucrare, stocare și analiza de probe de eritrocite și ser sanguin prin metode standard clinice. Tot în această etapă a fost optimizat protocolul de înregistrare a spectrelor Raman a eritrocitelor. De asemenea, s-a optimizat protocolul de înregistrare a spectrelor SERS (surface-enhanced Ramna scattering - Raman amplificat de suprafețe) a serului sanguin, în special prin optimizarea substratului de nanoparticule de argint.
Realizarea activităților enumerate mai sus au permis înregistrarea a 32 de spectre Raman de la probele de eritrocite de la 3 cohorte (diabetic, pre-diabetic, control). De asemenea, pe baza optimizării detecției selective SERS prin activare cu ioni de Ca2+ sau I-, au fost înregistrate spectrele SERS a 32 de probe de ser sanguin provenite de la cele 3 cohorte (diabetic, pre-diabetic, control).
Nivelurile de HbA1c au fost determinate pe 35 probe cu metoda HPLC, utilizând o coloană specifică de hemoglobină, în timp ce nivelurile de GA vor fi determinate folosind metoda Elisa. Nivelurile de GA și hemoglobină vor fi utilizate pentru construirea modelului statistic, împreună cu datele spectrale SERS și Raman. Pentru a controla exactitatea rezultatelor HPLC, nivelurile de HbA1c au fost determinate pe cele 35 de probe cu o altă metodă standard (imunoturbidimetrie) - aceasta fiind metoda standard utilizată în laborator, cu acreditare ISO 13485:2013.

Figura 1.3.1. Corelația între valorile determinate cu metoda imunoturbidimetrică, acreditată ISO 13485:2013 în laboratorul Pro-Vitam, și metoda HPLC, acesta fiind metodă de referință pentru determinarea hemoglobinei glicate. Se observă o corelație excelentă, atât în intervalul normal (<6%), cât și în intervalul patologic.
Analizele Raman și SERS a eritrocitelor și a probelor de ser sanguin au fost efectuate cu ajutorul unui spectrometru portabil i-Raman BWTek. Acesta a fost cuplat la un microscop optic prin intermediul unei fibre optice, ce ghidează laserul pentru excitarea Raman, și de asemenea radiația împrăștiată neelastic, Raman, către spectrometru. Configurația aleasă reprezintă un raport optim flexibilitate/acuratețe. Sistemul optic este total independent utilizarea acestuia nefiind legată de prezența în mediu de laborator. Sistemul Raman conceput este ușor de transportat, permițând instalarea cu ușurință a acestuia într-un mediu clinic (Figura 1.4.1).

Figura 1.4.1. Spectrometrul Raman portabil folosit la înregistrarea spectrelor Raman și SERS în cadrul activităților prevăzute în Etapa 1.
Efectul Raman rezonant este observat atunci când energia laserului cade în banda energetică a unei tranziții electronice a probei, rezultând o amplificare semnificativă a semnalului. Totuși, trebuie ținut cont că este o tehnică sensibilă la interferența cu fluorescența.
Protocolul SERS (surface-enhanced Raman scattering) necesită folosirea nanoparticulelor metalice cu proprietăți plasmonice pentru amplificarea semnalului Raman. Am folosit cu succes nanoparticule de argint sintetizate prin reducerea nitratului de argint cu clorhidrat de hidroxilamină (hya-AgNPs). Astfel, 17 mg de AgNO3 au fost dizolvate în 90 ml de apă ultrapură (rezistivitate mai mare de 18 MW) sub agitare. Separat, 17 mg de clorhidrat de hidroxilamină au fost dizolvate în 8.8 ml de apă ultrapură și s-au adăugat 1.2 ml NaOH 1%. Soluția de hidroxilamină a fost adăugată la soluția AgNO3 sub agitare iar soluția rezultată și-a schimbat imediat culoarea în galben închis. Soluția coloidală a fost păstrată la temperatura camerei.
Protocolul optimizat prevede amestecarea prin pipetare a 45 μL hya-AgNPs cu 5 μL de ser și 5 μL de Ca(NO3)2 10 mM. Cationii Ca2+ adsorb pe suprafața de argint a nanoparticulelor, formând adioni de Ca2+ care promovează chemisorbția speciilor încărcate negativ, așa cum este descris de modelul de adsorbție adion specific [ S.D. Iancu, A. Stefancu, V. Moisoiu, L.F. Leopold, N. Leopold, The role of Ag+, Ca2+, Pb2+ and Al3+ adions in the SERS turn-on effect of anionic analytes, Beilstein Journal of Nanotechnology, 10 (2019) 2338-2345].
Din acest amestec se depun 5 μL pe o lamă de microscop învelită în folie de aluminiu. Se focalizează obiectivul (20X) în interiorul picăturii și se aleg următorii parametrii de înregistrare:
- Timp de expunere 20 secunde
- Număr de achiziții 4
- Puterea laser 50%
1604-1608 cm-1 (ν19) și 1635-1640 cm-1 (ν10).
În continuare, s-au măsurat prin spectroscopie Raman 32 de probe de lizat celular, formate din fracțiunea de celule roșii, resuspendate în ddH20, de la pacienți cu diabet, controale și pre-diabetici.
Spectrele Raman au fost înregistrate folosind spectrometrul portabil prezentat în activitatea 1.4, echipat cu un laser cu lungime de undă de 532 nm. Parametrii achiziției au fost optimizați, iar toate probele au fost măsurate folosind aceeași parametri:
- Puterea laser de 30% (aprox. 10 mW)
- Timp de integrare de 10 secunde
- Obiectiv de microscop cu magnificare de 20X
Figura 1.5.3 prezintă spectrele Raman achiziționate de la cele 32 de probe de hemoglobină, în domeniul spectral 100-1800 cm-1.

Figura 1.5.3. Spectrele Raman achiziționate de la cele 32 de probe de hemoglobină, în domeniul spectral 100-1800 cm-1.
După cum se observă, spectrele Raman prezintă o variabilitate mare în ceea ce privește semnalul de fundal, însă benzile Raman corespund cu cele ale hemoglobinei, în special cele 2 benzi caracteristice la aprox. 1580 și 1650 cm-1.
Pentru a elimina semnalul de fundal, s-a aplicat o transformare liniară. Figura 1.5.4 prezintă cele 32 de spectre după eliminarea semnalului de fundal.

Figura 1.5.4. Spectrele Raman ale hemoglobinei după eliminarea semnalului de fundal, aplicând o transformare liniară.
Pentru a putea corela intensitatea semnalului cu concentrația hemoglobinei, este nevoie de normalizarea spectrelor Raman. Astfel, s-au normalizat spectrele Raman la unitate. Figura 1.5.5 prezintă spectrele Raman după normalizarea acestora la unitate.

Figura 1.5.5. Spectrele Raman după normalizarea la unitate.
Pentru a îmbunătăți pe cât de mult posibil raportul semnal/zgomot, s-au netezit spectrele Raman, folosind o funcție Savitsky-Golay, cu 5 puncte. Figura 1.5.6 prezintă spectrele Raman după aplicarea funcției de netezire.

Figura 1.5.6. Spectrele Raman după aplicarea funcției de netezire.
Figura 1.5.7 prezintă spectrul Raman mediu al celor 32 de probe de hemoglobină.

Figura 1.5.7. Spectrul Raman mediu al celor 32 de probe de hemoglobină.
Înregistrarea spectrelor SERS ale probelor de ser sanguin recoltate în cadrul acestei activități, în vederea detectării proteinelor, a necesitat un protocol mai elaborat. Spectrul Raman al unui coloid de argint uzual, de exemplu redus cu citrat (cit-AgNPs), blank, prezintă numai benzile Raman ale apei (inset, spectru (a)). Cu toate acestea, dacă adăugăm Ca(NO3)2, spectrul SERS al citratului este activat prin adsorbția specifică a citratului pe suprafața nanoparticulelor de argint, prin atomul său de O, așa cum este indicat de banda SERS de 230 cm-1, (spectrul (b)). Prin adăugarea secvențială de NaCl, KBr și KI în aceeași soluție la o concentrație finală de 10-3 M, ionii de halogenură înlocuiesc citratul de la suprafața nanoparticulelor datorită afinității lor mai mari pentru suprafața de argint și în consecință semnalului SERS de la Ag-Cl, Ag-Br și respectiv Ag-I este activat.
Prin utilizarea ionilor de Ca2+ pentru a facilita adsorbția speciilor anionice, am putea folosi concentrații mai mici de ioni de halogenură și a preveni agregarea soluției coloidale. De exemplu, după adăugarea NaCl 10-3 M la un cit-AgNPs, banda SERS Ag-Cl la 240 cm-1 nu poate fi observată. Cu toate acestea, după adăugarea de Ca(NO3)2, banda Ag-Cl este clar vizibilă, indicând chemisorbția ionilor de Cl-. Merită menționat faptul că spectrul SERS este activat / poate fi observat numai după adsorbția specifică a analiților pe nanoparticule (adică adsorpția la layer-ul Stern). Dacă analitul este fizisorbit (numai prin forțe electrostatice, în afara stratului Stern), spectrul SERS nu poate fi observat. Chemisorbția ionilor de halogenură este evidențiată și de schimbarea intensității legăturii Ag-X (X = Cl, Br, I) la diferite lungimi de undă. În special, am constatat că la 785 nm, legătura Ag-X este rezonantă, prezentând o intensitate mult mai mare decât la 532 nm, o observație care subliniază transferul de sarcină rezonantă între ionii de halogenură chemisorbiți și nanoparticulele de argint.
Pe baza modelului propus de Henglein și colab., chemisorbția speciilor nucleofile are loc în două etape:
În prima etapă (reacția 1), o moleculă a nucleofilului cedează o pereche de electroni într-un orbital neocupat de pe suprafață, atomul de suprafață, dobândind o ușoară sarcină pozitivă δ+ iar interiorul particulelor de argint o sarcină negativă corespunzătoare δ-. Un anumit număr de atomi de suprafață sunt „pre-complexați” sau „pre-oxidați” în acest fel până când se atinge un echilibru în care sarcina negativă acumulată în interior împiedică donarea electronică în continuare. În a doua etapă (reacția 2), molecula de oxigen preia excesul de sarcină negativă din interior și dizolvă metalul sub formă de complex molecular AgX.
![]()
![]()
Scăderea și lărgirea benzii rezonanței plasmonice a nanoparticulelor de argint de către reactivii nucleofili nu este încă înțeleasă în detaliu. Sunt posibile două efecte opuse: Sarcina negativă din interiorul particulelor pre-complexate crește valoarea lui σ care ar trebui să producă o deplasare spectrală spre albastru a benzii plasmonice. Pe de altă parte, structura dipolară δ+ - δ- de la suprafață ar putea fi echivalentă cu o scădere a razei (R) și aceasta ar trebui ducă la o scadădere în σ (densitatea electronilor), adică să provoace o deplasare spectrală spre roșu. În general, a fost observată o mică deplasare spre roșu (Figura 1.6.2.), indicând că al doilea efect prevalează. Scăderea efectivă a δ (densitatea electronilor) poate fi, de asemenea, responsabilă pentru creșterea lățimii benzii plasmonice. Dacă acest model este corect, alte molecule electrofile, alături de O2, ar trebui să poată oxida nanoparticulele de argint.
Astfel, adsorpția specifică a nucleofilelor (Br-, I-, etc.) poate fi monitorizată prin banda plasmonică de suprafață a nanoparticulelor de argint, după cum se observă în Figura 1.6.2.

Figura 1.6.2. Adsorpția specifică a ionilor de I- determină modificarea benzii plasmonice a nanoparticulelor de argint. Adsorpția ionilor de I- duce la scăderea în intensitate a benzii de transfer de sarcină I- - solvent de la 225 nm, un semn că I- este intr-adevăr adsorbit.
Banda de rezonanță plasmonică a nanoparticulelor de argint reduse cu citrat apare la 416 nm. După adaugarea a 0.1 mM KI, se observă o mică deplasare spre lungimi de undă mai mari (energii mai mici) a benzii plasmonice, caracteristice formării complecșilor Ag-I pe suprafața nanoparticulelor (spectrul roșu din Figura 1.6.2). Dacă în aceeași soluție adăugăm Mg2+, adsorpția ionilor de I- va fi favorizată, iar banda plasmonică se deplasează mai mult spre lungimi de undă mai mari. De asemenea, banda de la 225 nm, asociată transferului de sarcină dintre I- și solvent scade în intensitate datorită adsorpției I- pe suprafață nanoparticulei de argint.
Etapa 2
Etapa 2 a proiectului a prevăzut prelevarea probelor de sânge de la 150 pacienți diabetici, pre-diabetici și sănătoși în cadrul activităților desfășurate de partenerul de proiect. Probele au fost procesate în vederea cuantificării hemoglobinei și albuminei glicate prin metodele standard HPLC și imnulogice. Cuantificarea hemoglobinei glicate și clasificarea probelor (diabetic, pre-diabetic, control) s-a realizat și pe baza spectrelor Raman și SERS analizate prin metode de tip machine learning. Spectrele au fost obținute în urma protocolul optimizat în etapa 1 a proiectului. De asemenea, au fost testate diferite metode de preprocesare a spectrelor Raman și SERS. După alegerea protocolului optim de preprocesare a spectrelor a fost contruit un model statistic de clasificare a probelor în cele 3 grupe (diabetic, pre-diabetic, control) pe baza spectrelor Raman și SERS achiziționate. Clasificarea cea mai buna a rezulatat în urma folosirii algoritmului AdaBoost, obținându-se o acuratețe totală de 67%. Activitățile propuse în etapa 2 au fost realizate în proporție de 100%. În ceea ce privește cuantificarea hemoglobinei glicate s-a obținut un factor de corelație de 0.58 cu semnificație statistică între modelul PLS aplicat pe spectrele Raman și valorile HPLC ale hemoglobinei glicate.
Nivelurile de HbA1c au fost determinate pentru 150 probe cu metoda HPLC, utilizând o coloană specifică de hemoglobină, în timp ce nivelurile de GA au fost determinate numai pentru plasmă necongelată cu metoda ELISA. Nivelurile de GA și HbA1c au fost utilizate pentru construirea modelului statistic, împreună cu datele spectrale SERS și Raman.

Figura 2.2.1. Distribuția valorilor HbA1c determinate cu metoda HPLC.
Albumina glicată și hemoglobina glicată sunt doi markeri care arată nivelul mediu al glicemiei în ultimele 4-6 săptămâni (GA) și 3 luni (HbA1c). Deoarece aceste nivele pot varia în funcție de managementul bolii, nu se observă o corelație între valorile HbA1c și GA determinate din aceeași probă. Valori simultan mari de GA și HbA1c indică faptul că diabetul nu este ținut sub control.
Figura 2.2.2. Corelația între valorile GA și HbA1c pe probe la care valoarea GA a fost determinat din plasmă necongelată.
Analizele Raman și SERS a eritrocitelor și a probelor de ser sanguin au fost efectuate cu ajutorul unui spectrometru portabil i-Raman BWTek. Acesta a fost cuplat la un microscop optic prin intermediul unei fibre optice, ce ghidează laserul pentru excitarea Raman, și de asemenea radiația împrăștiată neelastic, Raman, către spectrometru. Configurația aleasă reprezintă un raport optim flexibilitate/acuratețe. Sistemul optic este total independent utilizarea acestuia nefiind legată de prezența în mediu de laborator. Sistemul Raman a fost amplasat în clinica Pro-Vitam pentru a achiziționa spectrele Raman ale (Figura 2.3.1).

Figura 2.3.1. Spectrometrul Raman portabil folosit la înregistrarea spectrelor Raman și SERS în cadrul activităților prevăzute în Etapa 2.
Figura 2.3.3 prezintă spectrele Raman achiziționate de la cele de probe de hemoglobină, în domeniul spectral 100-1800 cm-1.

Figura 2.3.3. Spectrele Raman achiziționate de la cele 139 de probe de hemoglobină, în domeniul spectral 100-1800 cm-1.
Figura 2.6.5. ilustrează reprezentara datelor în noul spațiu determinat de PC4 și PC9 pentru spectrele SERS ale hemoglobinei glicate.

Figura 2.6.5. Scatterplot în funcție de PC4 si PC9 pentru cele 2 grupe de probe grupa 0 (Albastru) care are valori scăzute de HbA1c și grupa 1(roșu) care are valori crescute de HbA1c.
Aceste două componente principale, PC4 și PC9 au fost folosite ca input pentru un model de machine learning, folosit pentru clasificarea probelor în cele două grupe. Ca model de clasificare am folosit Ada Boost cu următorii paramentrii: Număr de estimatori 50, Rata de învățare de 1, estimarea de bază activată, iar pentru metoda de boost, algoritmul de clasificare folosit a fost SAMME.R și funcția de pierdere a regresiei a fost setată ca fiind liniară. Motivul pentru care am folosit boosting este pentru a aplica secvențial o clasificare de algoritm slabă unei versiuni modificat repetat a datelor. Predicțiile de la toate datele sunt combinate prin vot majoritar pentru a produce predicția finală. Aceasta este o metodă care pornește de la o clasificare simplă a datelor care, gradual, se îmbunătățește rearanjând datele oferind o greutate mai mare eșantioanelor clasificate greșit. Pentru validarea modelului am folosit metoda “leave one out”, rezultatele obținute în urma validării au fost următoarele: Aria de sub Grafic (AUC) am obținut o valoare de 0.667, senzitivitatea are valoarea de 0.684, iar specificitate de 0.648. Am realizat în continuare matricea de confuzie pentru a putea observa numărul de probe care a fost prezis de catre inteligența artificială și am obținut următoarele valori pentru grupa 0 din cele 14 probe care se află în această grupă s-au prezis 8 (61.5%) ca fiind în grupa corectă iar 6 (27.3%) ca fiind în grupa greșită, iar pentru grupa 1 din cele 21 de probe din această grupe s-a prezis că 5 (38.5%) probe se afla in grupa greșită iar 16 (72.7%) în grupa corectă. (Figura 2.6.6.)

Figura 2.6.5. Matricea de confuzie în urma realizării modelului de inteligență artificială AdaBoost, pentru prezicerea plasării probelor în una din cele 2 grupe, (grupa 0 cu valori scăzute de HbA1c si grupa 1 cu valori crescute de HbA1c).
Pentru spectrele Raman setul de date a fost împărțit în 90% pentru învățare și 10% pentru validare.
Parametrii optimi pentru PLS au fost găsiți ca fiind număr de componente 2 și limita pașilor de iterație 10. Aplicând acești parametrii, a fost găsit un factor de corelare de 0.58 între datele prezise de modelul PLS aplicat pe spectrele Raman și valorile HPLC ale hemoglobinei glicate.

Figura 2.6.8. Reprezentarea grafică a valorilor prezise de modelul PLS construit pe baza spectrelor Raman ale hemoglobine glicate și valorile determinate prin metoda standard HPLC. Probele reprezentate în grafic reprezintă probele alese pentru validara modelului.
Etapa 3
Etapa 3 a proiectului a prevăzut prelevarea probelor de sânge de la 60 pacienți diabetici, pre-diabetici și sănătoși. Probele au fost preparate în vederea cuantificării hemoglobinei și albuminei glicate prin metodele standard. Pentru toate probele au fost înregistrate spectre Raman și spectre SERS folosind protocolul optimizat în etapa 1 a proiectului. Probele au fost procesate conform pașilor optimi determinați în etapa 2 a proiectului.
A fost validat modelul statistic construit în etapa 2 a proiectului pentru clasificare a probelor în cele 3 grupe (diabetic, pre-diabetic, control) pe baza spectrelor Raman achiziționate, pentru care s-a determinat specificitatea, senzitivitatea și acuratețea totală. De asemenea, a fost validat modelul statistic construit în etapa 2 a proiectului pentru determinarea concentrației de proteine glicate pe baza spectrelor Raman și SERS achiziționate.
Activitățile propuse în etapa 3 au fost realizate în proporție de 100%, fiind analizate în studiu un număr de 60 de probe de sânge. Pentru fiecare probă s-a realizat determinarea concentrației de hemoglobinei și albuminei glicate, atât prin metode standard HPLC și imnulogice, cât și prin spectroscopie Raman. Modele statistice construite în etapa 2 au fost validate.
Criteriile de incluziune și prelucrarea datelor cu caracter personal prevăzute în prima etapă au fost respectate pentru fiecare pacient. Au fost recolatate probe de sânge de la 60 de pacienți utiliând vacutainere cu și fără anticoagulante. Pentru fiecare probă serul a fost separat de eritrocite. Eritrocitele au fost resuspendate în apă dublu distilată pentru a obține un lizat celular. Determinăriile concentrațiilor de hemoglobină glicată au fost realizate pe proba de lizat ceulalre, iar determinările concentrațiilor de albumină glicată au fost realizate pe probele de plasmă. Probele au fost stocate la -20°C sau -80° C. Împărțirea probelor în cele 3 grupe, diabetici, pre-diabetici și control a fost realizată pe baza protocolului din Activitatea A1.1.
Au fost înregistrate spectre Raman ale eritrocitelor în vederea determinării concentrației de hemoglobină glicată folosind apectrometrul portabil i-Raman BWTek cuplat la un microscop optic prin intermediul unei fibre optice și o linier laser 532 nm (Figura 3.2.1).

Figura 3.2.1 Spectrometrul Raman portabil cuplat la linia laser 532 nm folosit pentru analiza probelor de hemoglobină.
Au fost înregistrate spectre SERS ale probelor de plasmă în vederea determinării concentrației de albumină glicată folosind un spectrometru portabil Raman OceanOptics cuplat la o linie laser 638 nm.
Validarea metodei de achiziție a spectrelor Raman ale proteinelor glicate și a modelului statistic pentru gruparea pacienților în pacienți cu nivelul HbA1<6.5% și pacienți cu HbA1>6.5% pe baza spectrelor Raman ale proteinelor glicate.
Au fost respectați parametrii de preparare a probelor și parametrii de achiziție determinați ca fiind optimi în etapa 2. De asemenea, spectrele achiziționate au fost procesate conform pașilor descriți în etapa 2 a proiectului.
Figura 3.2.2 prezintă spectrele Raman achiziționate de la cele de probe de hemoglobină, în domeniul spectral 100-1800 cm-1 după pașii de procesare.
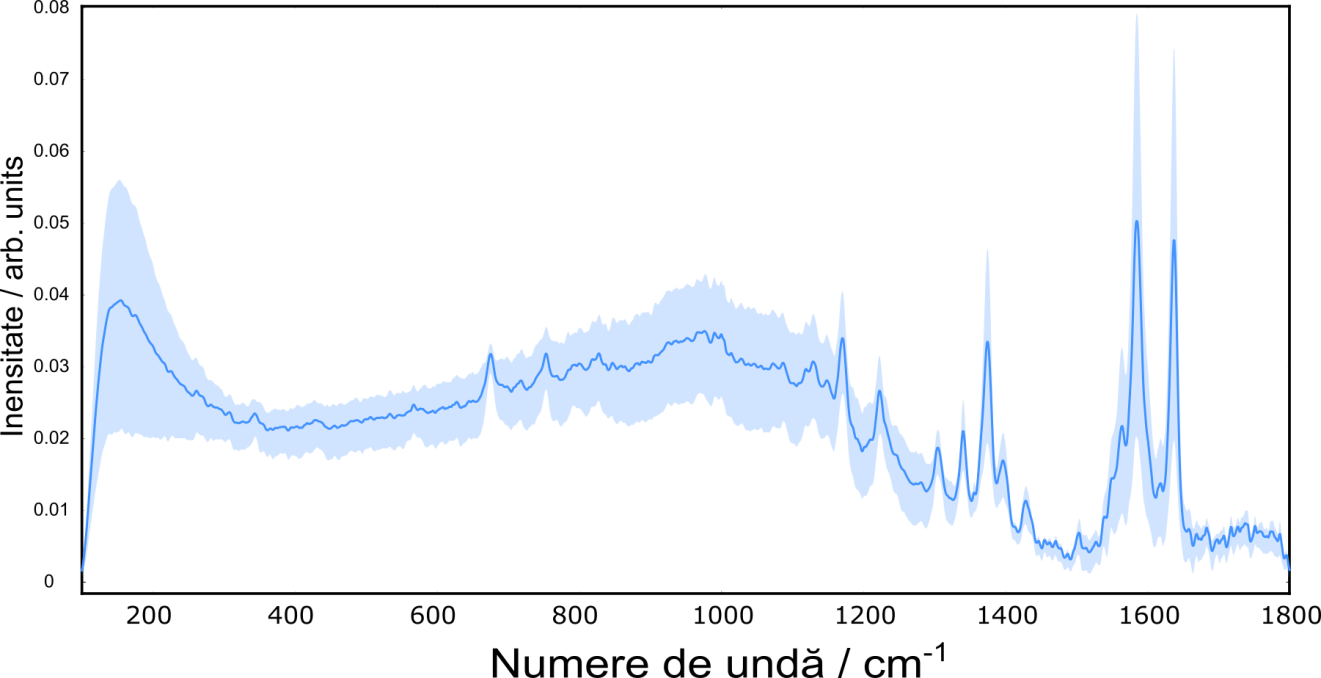
Figura 3.2.2 Spectrele Raman achiziționate de la cele 60 de probe de hemoglobină, în domeniul spectral 100-1800 cm-1.
După cum se observă, spectrele Raman prezintă cele 2 benzi caracteristice hemoglobinei la aprox. 1580 și 1650 cm-1. Validarea modelelor statistice dezvoltate în etapa 2 pentru gruparea pacienților în grupele pacienți cu nivelul HbA1<6.5% și pacienți cu HbA1>6.5% a fost efectuată în soft-ul Quasar (Orange). Pe scurt, s-a aplicat Analiza în Componente Principale pentru a reducere dimensionalitatea datelor după care s-a analizat performanța modelului AdaBoost construit în etapa 2 pe cele 60 de probe de hemoglobină. Au fost folosiți aceeași parametrii pentru modelul de clasificare construit în etapa 2: număr de estimatori 50, Rata de învățare de 1, estimarea de bază activată, iar pentru metoda de boost, algoritmul de clasificare folosit a fost SAMME.R și funcția de pierdere a regresiei a fost setată ca fiind liniară.
Am realizat în continuare matricea de confuzie pentru a putea observa numărul de probe care a fost prezis corect de către modelul statistic construit (Figura 3.2.3). Din matricea de confuzie s-au determinat valorile pentru specificitate de 56.25%, senzitivitate de 70.45% și o acuratețe totală de 66.67%.

Figura 3.2.3 Maricea de confuzie returnată de validarea modelul statistic pentru gruparea spectrelor Raman ale celor 60 de probe de hemoglobină.
Validarea modelului statistic construit pentru determinarea concentrației de hemoglobină glicată
Validarea modelului statistic dezvoltat în etapa 2 pentru determinarea concentrațiilor de hemoglobină glicată a fost efectuată în soft-ul Quasar (Orange). S-a folosit același fișier utilizat pentru gruparea pacienților în grupele pacienți cu nivelul HbA1<6.5% și pacienți cu HbA1>6.5%, care conține spectrele Raman de la 60 de probe de hemoglobină procesate conform pașilor descriși în etapa 2.
S-a folosit analiza Partial Least Square (PLS) pentru a urmării corelarea între datele spectrale și valorile concentrației de hemoglobină glicată determinate prin metoda standard HPLC. Parametrii optimi pentru PLS determinați în etapa 2 (fiind număr de componente 2 și limita pașilor de iterație 10) au fost folosiți pentru validarea modelului. Eroarea medie a modelului a fost de 1.46%.Tabel 3.2.1. Parametrii de performanță a modelului statistic pentru determinarea concentrației de hemoglobină glicată.
Media erorilor |
Mediar erorilor la pătrat |
1.46 |
2.07 |
Validarea metodei de achiziție a spectrelor SERS ale proteinelor glicate și a modelului statistic construit pentru determinarea concentrației de albumină glicată
Înregistrarea spectrelor SERS a celor 60 de probe de plamsă a fost realizată conform pașilor determinați în etapa 2. Spectrele Raman (Figura 3.2.4) achiziționate au fost procesate conform pașilor determinați în etapa: a fost păstrat domeniul spectral 800-1800 cm-1; s-a folosit funcția Rubber-band pentru reducerea fundalului; s-a aplicat metoda de normalizare vector; s-a folosit funcția Savitsky-Golyai cu un grad al polinomului de 2 și o fereastră de 10 pentru netezirea zgomotului din spectrele Raman.

Figura 3.2.4 prezintă media spectrelor SERS ale plasmei pacienților înrolați în studiu împreună cu deviația standard.
Au fost folosite ca date de intrare în modelul statistic spectrele procesate după protocolul optim: reducerea semnalului de fundal folosind savtsky-golyai, normalizare vector și netezire.
Validarea modelelor statistice dezvoltate în etapa 2 pentru determinarea concentrațiilor de proteină glicată a fost efectuată în soft-ul Quasar (Orange). Datele spectrale au fost distribuite într-un fișier excel astfel încât pe fiecare coloană a fost reprezentată câte o variabilă.
Tabel 3.2.2. Parametrii de performanță a modelului statistic pentru determinarea concentrației de albumină glicată.
Media erorilor |
Mediar erorilor la pătrat |
3.45 |
6.60 |
S-a folosit analiza Partial Least Square (PLS) pentru a urmării corelarea între datele spectrale și valorile concentrației de albumină glicată determinate prin metoda standard HPLC. Parametrii optimi pentru PLS determinați în etapa 2 (fiind număr de componente 2 și limita pașilor de iterație 10) au fost folosiți pentru validarea modelului. Aplicând acești parametrii, modelul a arătat o eroare medie de 3.45 mg/ml.






