MetDNA - PN-III-P4-ID-PCE-2020-1292
Rezultate 2022
A doua etapă a proiectului a prevăzut realizarea unui protocol optimizate pentru detecția oncometabolitului 2HG din probe de ser prin spectroscopia SERS. Spectrele SERS ale serului care conține oncometabolitul 2HG au fost procesate în vederea construirii unui model statistic de cuantificare a concentrației 2HG. S-a construit un model statistic de tip partial least squares, al cărui rezultat a fost corelat cu concentrația de 2HG cu un factor de corelare de R=0.98.
De asemenea, metoda îmbunătățită de detecție SERS a ADN-ului genomic dezvoltată în prima etapă a proiectului a fost aplicată pentru adsorbția selectivă a ADN-ului canceros și necanceros. A fost analizată adsorbția ADN-ului genomic extras din 9 linii celulare cu diferite grade de metilare în domeniul 0.16-1.04 %, observându-se un trend în adsorbție în funcție de gradul de metilare a ADN-ului. Banda SERS a citozinei prezintă o intensitate proporțională cu gradul de metilare al ADN-ului arătând că ADN-ul necanceros (grad metilare mare) adsorbe preponderent la suprafața metalică de argint. Mai mult, spectroscopia de fluorescență a permis analizarea cantității de ADN liber, neadsorbit. Pe suprfața a 0.3x1010 AgNPs 40% din ADN-ul necanceros este neadsorbit, în timp ce pentru ADN-ul canceros un procent de 58-80% este neadsorbit pe suprafața nanoparticulelor de argint (AgNPs).
Adsorbția la suprafața nanoparticulelor de argint depinde de afinitatea moleculelor pentru suprafața de argint, moleculele fiind în competiție. Ca urmare, surfactantul folosit pentru stabilizarea nanoparticulelor în soluție poate influența adsorbția oncometabolitului 2HG la suprafața nanoparticulelor și implicit detecția acestuia prin spectroscopie SERS.
Pentru a evita posibila interferență dintre surfactant și 2HG au fost testate 3 soluții coloidale de argint, în care nanoparticulele de argint (AgNPs) au fost stabilizate cu surfactanți diferiți: AgNPs stabilizate cu polietilenglicog (PEG-AgNPs), AgNPs stabilizate cu citrat (cit-AgNPs) și AgNPs stabilizate cu hidroxilamină hidrocloridă (hya-AgNPs). În acest scop, au fost achiziționate spectre SERS ale 2HG 10-3 M folosind ca substrat metalic cit-AgNPS, PEG-AgNPs și hya-AgNPs activate cu ioni de Al3+ (Figura 2.1.1).
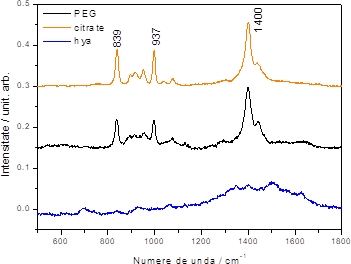
Figura 2.1.1. Spectrul SERS al 2HG 10-3M achiziționat în prezența nanoparticulelor de argint stabilizate cu polietilen glicol (PEG-AgNPs), citrat (cit-AgNPs) și hidroxilamină hidrocloridă (hya-AgNPs).
Benzile caracteristice 2HG determinate în prima etapă a proiectului, banda SERS 839, 937 și 1400 cm-1 au fost observate în cazul cit-AgNPs, PEG-AgNPs, dar nu și hya-AgNPs. 2HG poate înlocui de la suprafața AgNPs citratul, PEG, dar nu și Cl- din hya-AgNPs. Ca urmare în cazul hya-AgNPs, 2HG nu poate adsorbi la suprafața nanoparticulelor. Astfel, pentru detecția 2HG din biofluide am folosit ca substrat metalic cit-AgNPs și PEG-AgNPs.
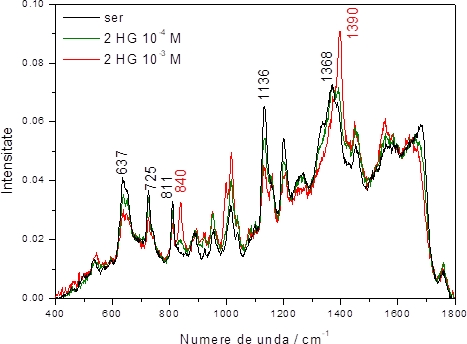
În continuare, am evaluat detecția selectivă a oncometabolitului 2HG dintr-un amestec de 2HG și ser sanguin. Figura 2.1.2 prezintă spectrul SERS caracteristic unei probe de ser sanguin, în care predomină benzile metaboliților purinici: acid uric, xantină și hipoxantină (637, 725, 811, 1136, 1368 cm-1). Spectrul a fost achiziționat pe o probă reprezentată de un amestec 1:9 de ser sanguin și cit-AgNPs, peste care s-a adăugat 5x10-4 M Ca2+. Peste acest amestec s-a agăugat ulterior 2HG în concentrație finală 10-4 M, respectiv 10-3 M. La adăgarea 2HG în soluție, s-a observat apariția benzilor SERS 840 și 1390 cm-1, benzi caracteristice 2HG. Banda SERS de la 840 cm-1 poate fi diferențiată ușor de restul benzilor SERS din serul sanguin. Pe de altă parte, banda 1390 cm-1 prezintă un fundal intens, datorat benzii largi de la 1368 cm-1 caracteristic tuturor metaboliților purinici. Pentru a putea atribui specific contribuția 2HG la spectrul SERS ne-am focusat în continuare pe analizarea regiunii 800-900 cm-1, unde banda SERS 2HG se diferențiază bine de restul semnalului.
Tendința de grupare nesupervizată a spectrelor SERS în funcție de prezența oncometabolitului 2HG este prezentată în Figura 2.1.4. Score plot-ul prezentat evidențiază capacitatea de detecție selectivă a 2HG dintr-un amestec de ser sanguin cu 2HG în concentrații cunoscute folosind spectroscopia SERS. Remarcăm tendința probelor de a se grupa în cele 2 categorii vizate, cu o singură excepție: observăm o probă outlier din categoria HGA ce se regăsește în categoria S.
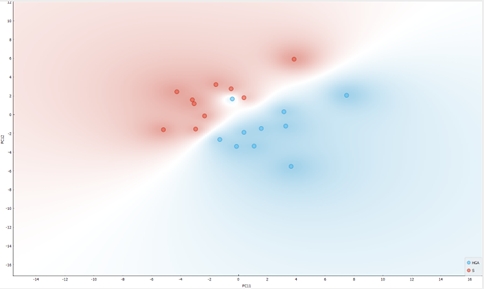
Figura 2.1.4. Gruparea nesupervizată probelor de ser sanguin control (roșu), respectiv ser sanguin cu 2HG 10-3 M concentrație în ser cu proteine (albastru).
Au fost comparate spectrele SERS achiziționate pe spectrele de urină care conțin 2HG 10-3 M achiziționate în prezența cit-AgNPs și PEG-AgNPs (Figura 2.2.1).
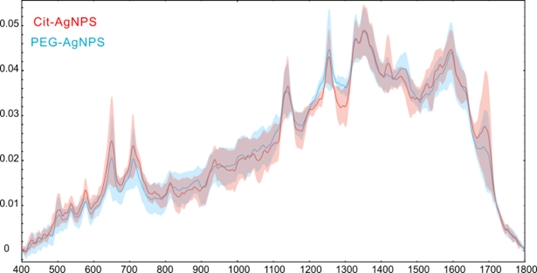
Figura 2.2.1. Spectrele SERS ale probelor de urină amestecate cu 2HG 10-3 M achiziționate folosind ca substrat metalic cit-AgNPs (roșu) și PEG-AgNPs (albastru). Spectrele sunt reprezentate ca medie și deviație standard.
Construirea unui model de regresie PLS de determinare a concentrației de 2HG din probele de urină au fost repetat pentru spectrele achiziționate folosind ca substrat metalic cit-AgNPs. S-a obținut un factor de corelare R=0.980 cu o eroare de 0.0001 pentru antrenarea modelului pe baza întregului spectru SERS, și un factor de corelare R=0.790 pentru utilizarea regiunii spectrale 800-900 cm-1 (Figura 2.2.4)
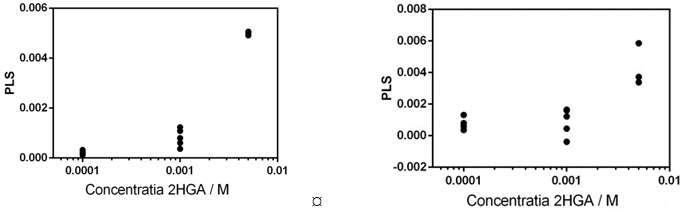
Figura 2.2.4. (A) Relația dintre concentrația de 2HG prezisă de modelul PLS și valorile reale. (B) Relația dintre concentrația de 2HG prezisă de modelul PLS aplicat pe domeniul spectral 800-900 cm-1 și valorile reale.
Cele mai bune rezultate în determinarea concentrației de 2HG din biofluid a fost obținute folosind un model PLS antrenat pe domeniul spectral 400-1800 cm-1, spectre achiziționate folsoind ca substrat metalic cit-AgNPs.
Pentru a determina cantitatea de ADN liber, au fost citite intensitățile de emisie în domeniul spectral UV-Vis ale unui fluorofor legat specific de ADN dublu catenar. S-a evaluat emisia fluoroforului SybrGreen I la 520 nm. S-a variat cantitatea de ADN, pentru a evalua cantitatea maximă de ADN ce poate fi adsorbit pe 1.5x1010 nanoparticule de argint (valoare determinată prin metoda Nanoparticle Tracking Analysis, NanoSight). S-a determinat prin fluorescență cantitatea de ADN rămas liber în soluție (Figura 2.3.4). Pentru mai mult de 140 ng de ADN, cantitatea de ADN rămas liber în soluție crește liniar, deoarece suprafața de argint este saturată.
Scăzând cantitatea totala de ADN, se observă o tendință de plafonare a semnalului fluorescent, ADN-ul fiind adsorbit.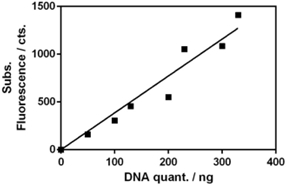
Figura 2.3.4. Emisia fluorescentă a fluoroforului SybrGreen legat de ADN liber, neadsorbit pe suprafața nanoparticulelor de argint.
Măsurătorile SERS au arătat că ADN-ul control are o afinitate mai mare pentru suprafața AgNPs comparativ cu ADN-ul canceros cu grad de metilare mai mic, cantitatea de ADN control adsorbit fiind mai mare.
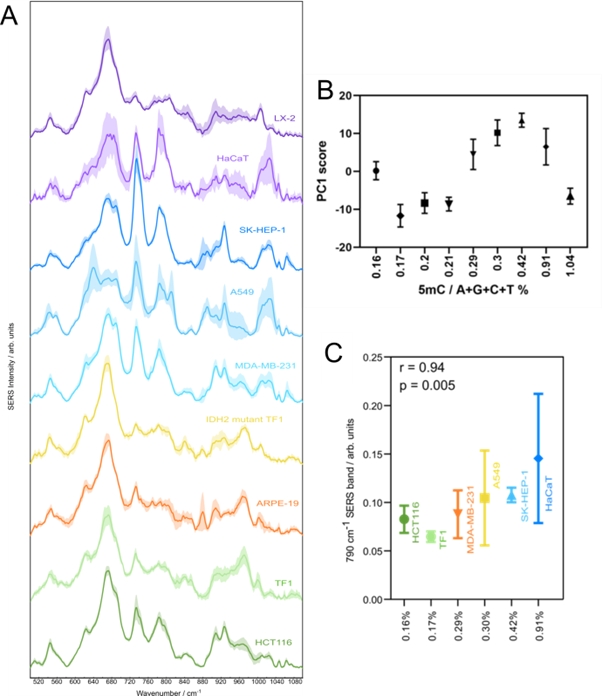
Figure 2.4.1. (A) Spectrele SERS medii a probelor de ADN extras din culturile celulare cu grade de metilare diferite. Spectrele sunt prezentate ca medie și deviație standard. (B) Scorurile pe PC1 ale probelor de ADN în funcție de gradul de metilare al ADN-ului, Datele sunt prezentate ca medie și deviație standard. (C) Corelația dintre intensitate benzii SERS a citozinei (790 cm-1) și gradul de metilare.
Complementar cu SERS, unde am analizat ADN-ul adsorbit la suprafața AgNP, am folosit spectroscopie de fluorescență pentru a detecta cantitatea de ADN liber, nelegat de suprafața de argint, arătând că este corelată negativ cu nivelul de 5mC.
Spectroscopia de emisie de fluorescență a permis urmărirea ADN-ului neadsorbit, liber pe suprafața AgNP-urilor. A fost folosit un cititor de microplăci pentru măsurarea intensității de fluorescență. ADN-ul a fost marcat cu fluorofor Sybrgreen I (SG), despre care se știe că emite fluorescență numai atunci când este legat de ADN-ul dublu catenar. Pentru a exclude concentrația de ADN ca factor de confuzie, toate probele de ADN au fost diluate la aceeași concentrație. 140 ng de ADN au fost amestecate cu AgNPs (concentrații de 0.3-4.75 x 1010 NPs), Ca(NO3)2 5x10-4 M și apă ultrapură până la un volum final de 1 ml. Amestecul a fost centrifugat timp de 15 minute la 7300 x g şi supernatantul a fost luat pentru analiza fluorescenţei. 180 µl de supernatant au fost amestecați cu 20 µl de SG1X și plasați într-o placă cu 96 x 96 godeuri. Probele au fost excitate folosind o lungime de undă de 470±20 nm și a fost colectată emisia de fluorescență la 520 nm. Măsurătorile de fluorescență au fost repetate de 3 ori și rezultatele sunt prezentate ca medie și abatere standard. Influența numărului de nanoparticule și a ADN adsorbit a fost prevăzută cu o relație exponențială între proporția de ADN adsorbit (A) și raportul de nanoparticule la ADN (r) de forma: A=A0exp(-kr).
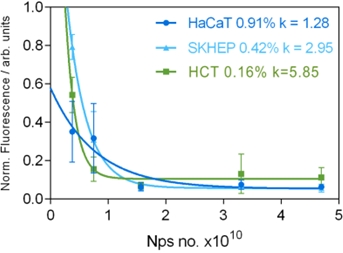
Figura 2.4.2. Dependența concentrației de ADN liber, neadsorbit pe AgNPs de gradul de metilare al ADN-ului.
Am determinat rata de adsorbție a ADNg pe suprafața AgNP-urilor utilizând 140 ng ADN pentru fiecare probă și variind concentrația de NP (și implicit suprafața metalică disponibilă). Emisia de fluorescență la 520 nm a fost măsurată pentru soluția, care conține ADN nelegat marcat cu SG. Pentru o concentrație de hya-AgNP-uri mai mare de 1.75 x 1010 nanoparticule tot ADN-ul este adsorbit, indiferent de concentrația de 5 mC. Diferențele în rata de adsorbție a ADN-ului pe suprafața AgNP-urilor sunt observate pentru concentrația scăzută de AgNP, unde este disponibilă o suprafață mică de adsorbție. Rata de evoluție a curbei exponențiale a scăzut cu un nivel mai mare de 5 mC, de la k=5.85 pentru HCT (0.16% 5mC) la k=2.95 pentru SK-HEP-1 (0,42% 5mC) și k=1.28 pentru HaCaT (0.91% 5mC). Mai mult, pentru concentrație mică de nanoparticule, 0.3x1010 nanoparticule doar 38% din ADN control (HaCaT) a rămas în soluție, restul fiind adsorbit pe nanoparticule AgNP. În schimb, pentru ADN-ul canceros, 57% (SKHEP cu grad de metilare 0.42%) respectiv 80% (HCT cu grad de metilare 0.16%) din ADN a rămas liber în soluție. Astfel, măsurătorile SERS și fluorescența au arătat că concentrația de 5 mC în gDNA duce la rate diferite de adsorbție ale gDNA pe suprafața AgNPs, care pot fi exploatate pentru a detecta concentrația de 5 mC.
Pentru a evalua concentrarea ADN-ului folosind diferența de afinitate la suprafața de argint dintre ADN cancero și sănătos a fost marcat ADN-ul din linia celularp HCT115 cu 5-fluorouracil (5-FU). Au fost achizitionate spectre SERS de la cate 3 probe de ADN extras din linia celulara LX-2 si din linia celulara HCT116 marcata cu 5FU (Figura 2.4.3) pentru a evalua diferențele spectrale dintre cele două linii, diferențe care vor fi folosite pentru determina care ADN adsorbe preponderent dintr-un amestec.
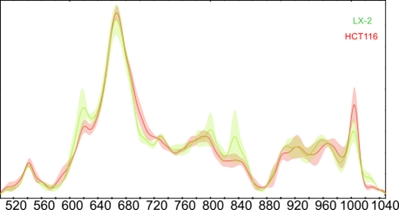
Figura 2.4.3. Spectrele SERS medii ale ADN-ului extras din linia canceroasă HCT116 marcată cu 5-fluorouracil și din linia celulară necanceroasă LX-2.
S-a observat o intensitate mai mare la 790 cm-1 pentru linia LX-2, și o intensitate mai mare la 1005 cm-1 pentru HCT116. Mai mult linia HCT116 fiind marcată cu 5-FU prezintă o bandă suplimentară la 760 cm-1.
Au fost preparate amestecuri de ADN HCT116 (canceros) și LX-2 (control), cu diferite cantități de ADN după cum urmează:
- 140 ng LX-2 și 0 ng HCT116
- 100 ng LX-2 și 40 ng HCT116
- 70 ng LX-2 și 70 ng HCT116
- 40 ng LX-2 și 100 ng HCT116
- 0 ng LX-2 și 140 ng HCT116
A fost evaluată adsorbția ADN-ului pe AgNP din amestecurile de ADN canceros și control prin spectroscopia SERS.
Pentru a evalua cantitatea de ADN adsorbit pe nanoparticle am analiza relația dintre banda SERS de la 760 cm-1 și raportul de ADN canceros și control. Se observă prezența benzii 760 de la HCT116 doar pentru probele unde nu există LX-2, sau cantitatea de LX-2 este foarte mică. Atunci când cantitatea de LX -2 este egașă cu HCT116, diferența de afinitate dintre cele două face ca doar LX-2 să adsboarbă întrucât banda 760 cm-1 dispare din spectrul SERS. Crescând cantitatea de LX-2, nu se mai detectează HCT116 pe suprafața AgNPs.






